高炉煤气全干式精脱硫工艺路线的探究
孙曼丽1 张 敏1 王 键1
(1.中晶环境科技股份有限公司 北京市 100176)
摘要:简要分析了高炉煤气特性及采用源头精脱硫的必要性。研究了煤气有机硫转化及无机硫吸收技术的现状及特点,提出高炉煤气精脱硫技术路线。其中“预处理+水解催化法+干法脱硫”,采用全干式脱氯、水解及脱硫过程,可保证煤气热值,延长设备寿命,是一种适用于高炉煤气精脱硫的简单高效的可行性新工艺路线。
关键词:高炉煤气;精脱硫;全干式;水解催化;脱氯
0 引言
随着国家环保政策的日趋严格,钢铁行业超低排放改造压力逐步增大。高炉煤气随之进入人们的视野,成为行业改造的重点和难点。高炉煤气是钢铁企业炼铁过程的副产品,具有热值偏低、气量大的特点[1]。一般流程中,高炉煤气经干法除尘后,进入余压透平发电装置(TRT),回收压力和热能,继而送下游热风炉、加热炉、烧结机等工序,经燃烧后,其二氧化硫排放浓度为100mg/Nm3~200mg/Nm3左右,远高于超低排放标准,需进行脱硫净化[2]。传统脱硫方式一般采用末端治理,但该种方式往往存在多点设置、设备分散、占地面积大、运行成本高的弊端。而随着钢厂节能减排及循环经济的发展,该种方式已越来越难以适应当前环保要求。基于此,采用源头治理的方式,实施煤气精脱硫后再送入各使用点,方便集中管理且减轻末端治理负担[3-4]。
综合国内外的研究与应用,高炉煤气精脱硫技术目前大多处于理论研究及试验阶段,缺乏稳定的工业化应用。本文基于高炉煤气的特点,结合国内外相关技术发展,分析探讨具有可行性的高炉煤气精脱硫工艺。
1 高炉煤气特性及脱硫必要性
1.1 高炉煤气特性
高炉煤气主要成分为一氧化碳(CO)、二氧化碳(CO2)、氮气(N2)、氢气(H2)、烃类(CxHy)等,同时含有少量硫化物及粉尘,详见表1。煤气中总硫含量为50~200mg/Nm3,其中有机硫以羰基硫(COS)为主,约占总硫70%左右,并有微量二硫化碳(CS2);无机硫以硫化氢(H2S)为主,约占总硫30%左右[3-5]。
表1 高炉煤气主要成分占比
|
煤气组分 |
Φ(CO) |
Φ(CO2) |
Φ(N2) |
Φ(H2) |
Φ(CH4) |
Φ(O2) |
|
占比/% |
19.8~23 |
16.8~19.4 |
49.6~59.6 |
1.7~5.9 |
0~0.5 |
0~0.8 |
1.2 高炉煤气精脱硫必要性
近年来,国家和地方政府陆续颁布了多项相关政策。2019年生态环境部发布的《关于推进实施钢铁行业超低排放的意见》中明确指出,“加强源头控制,高炉煤气、焦炉煤气应实施精脱硫”;同年,河南省发改委发布了《2019年大气污染防治攻坚战推进方案》,规定 “高炉煤气、焦炉煤气实施精脱硫改造,煤气中H2S浓度小于20mg/Nm3”。高炉煤气精脱硫已经逐渐开始具体量化。基于超低排放要求末端SO2控制在35mg/Nm3以下,高炉煤气精脱硫处理势在必行。精脱硫后可明显降低对输送管网的腐蚀,提高煤气输送和使用的安全性。同时,源头精脱硫,可解决设备分散的问题,便于集中管理和节约成本。总体而言,实施高炉煤气精脱硫在环保政策、环境效益、安全性能等多方面具有明显优势。
1.3 有机硫的转化
传统煤气净化集中于无机硫、粉尘去除,忽略了有机硫的净化。高炉煤气中有机硫以COS为主,COS化学性能较为稳定,不适于常规脱硫方式[6]。常规方法中胺吸收法去除率约60%左右,脱硫后废液难处理,无法满足高炉煤气净化需求[7]。氧化法受限于高炉煤气中存在的大量还原性可燃气体,氧化环境难以控制,不宜大规模使用。加氢还原法主要应用于石化领域,在催化剂作用下通过加氢将COS转化为H2S后进行脱除,其具有转化率高达99.99%的优点,但该方法操作压力在3.5~4.0MPa、反应温度280~400℃,对设备要求较高。故本文将重点探讨水解催化法在高炉煤气精脱硫应用方面的可行性。
国外于20世纪50年代开始进行COS水解催化剂的研究,国内太原理工大学于70年代开始进入该领域,此后陆续研发出可工业化应用的水解剂。COS水解为碱催化反应,其反应过程如(1)所示,该反应是一级可逆放热反应,低温条件有利于平衡向右进行,提高转化率。水解催化剂是水解催化法的关键核心,当前研究较多的是γ-Al2O3基改性水解催化剂,中低温度下使用,一般在30~250℃[8-10]。
![]()
1.4 TRT前水解催化法
有机硫水解装置的布置一般分为TRT余压发电前、发电后。置于TRT前是由于煤气除尘后的温度一般为130~180℃,该温度下中温水解催化剂具有较高水解活性,效率可达95%以上[8]。邹晓超[11]探讨了TRT前水解转化工艺的可行性,除尘后的系统压力、温度满足水解催化工艺应用条件。但同时,水解催化剂的寿命受煤气中COS含量、H2S含量、氧含量、粉尘及温度的影响[12],煤气温度较高,易导致水解催化剂氧中毒,硫沉积及硫酸盐化等,从而致使水解催化剂活性降低。同时,该种方式,不可避免的会造成煤气温度降低和压力损失,导致热量损失,影响TRT发电效率。
1.5 TRT后水解催化法
考虑避免对TRT发电效率的影响,宜将水解催化装置设置在TRT之后,采用低温水解催化剂。煤气经TRT发电之后,压力10~15kPa、温度20~100℃。该方式可有效避免脱硫工艺对TRT系统的影响[8]。湖北省化学研究院开发的水解催化剂T504[13],在常温(30℃)下转化率可高达99.9%,但在水汽、CO2和H2S酸性气体的影响下活性会降低。在此基础上,该研究院进一步研制了COS水解催化剂EH-4,以γ-Al2O3为载体,浸渍多种活性组分和特种助剂,经干燥、焙烧制得成品水解剂,水解效率更加稳定[14]。
值得注意的是,煤气中氯离子(Cl-)具有酸性,会使催化剂表面的酸性位点增加,导致水解催化剂活性下降。Cl-的脱除方式主要有两种:一种是湿法碱液吸收,具有效率高、成本低的优点,但会造成煤气温度降低、水汽增加,加重后续设备腐蚀,不适用于高炉煤气;另一种是采用固定床干式脱氯剂[15],目前国内已有较多的团队开发出宽温脱氯剂,脱氯效率在95%以上,满足工业化使用。因此,本研究建议在水解催化装置之前设置固定床预除氯装置,保护水解催化剂、延长其使用寿命。
1.6 无机硫的吸收
高炉煤气中需要脱除的H2S,一部分来自炼铁产生的H2S,一部分来自有机硫水解转化的H2S,总H2S浓度一般在50~200mg/Nm3左右。H2S的脱除技术相对于COS脱除较为成熟,常见的技术有湿法脱硫、干法脱硫[16]。
1.7 湿法脱硫
湿法脱硫工艺属于成熟技术,依靠强碱性溶液进行吸收,如氢氧化钠(NaOH)溶液。脱硫吸收装置采用空塔喷淋,即在吸收塔内碱液与高炉煤气逆向接触,反应式如(2),可较为彻底的脱除高炉煤气中的H2S组分。
![]()
湿法脱硫系统具有效率高、系统阻力小、节约占地面积等优点,但也存在以下缺点:一是系统废液处理难,产生的Na2S等复盐难以处理,回收硫单质流程复杂且成本高;二是反应后生成的部分盐会存在于煤气中,当后续煤气管段温度、压力降低后盐类易结晶,导致管道及阀门等堵塞;三是其会造成煤气含水率的增加,降低煤气热值;四是煤气中存在大量的CO2气体,必然造成碱液用量增大,导致运行费用增加。
1.8 干法脱硫
干法脱硫依靠固体吸附剂或吸收剂对H2S进行吸附吸收,常用技术包括氧化铁脱硫、氧化锌脱硫、活性炭脱硫等。干法脱硫技术精度高、操作流程简单,适用于无机硫浓度较低的精细脱硫项目[19]。
1.8.1 氧化铁脱硫剂
氧化铁脱硫剂是使用最为广泛的金属氧化物脱硫剂,该脱硫剂原材料成本低、生产流程较为简单且效率高,具有高穿透硫容和脱硫精度,普遍应用于各类工业气中H2S的脱除,是一种经济且高效的常温脱硫剂。普遍认为煤气中的H2S首先吸附在铁基脱硫剂表面,在该液膜表面进行解离,生成H+、SH-、S2-,解离出的SH-、S2-与氧化铁快速反应,生成Fe2S3·H2O。反应式如(3)。另外,煤气中氧含量一般为0~0.8%,当煤气中含有微量氧时,脱硫产物与氧发生反应生成硫单质,脱硫剂实现再生,反应式如(4)[17]。
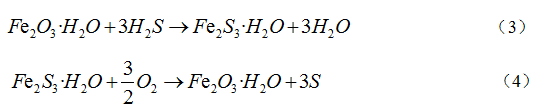
目前国内多家研究机构、企业等已开发出强度高、硫容大、脱硫精度高的氧化铁脱硫剂,脱硫性能明显提高。已开发应用的T502型、TG型、NF型氧化铁脱硫剂在常温下均具有良好的脱硫性能。
1.8.2 氧化锌脱硫剂
氧化锌(ZnO)也是研究应用较多的金属氧化物脱硫剂,与H2S反应生成十分稳定的硫化锌(ZnS)。其在中高温度条件下,具有较高的硫容;而在低温时,脱硫速率远低于氧化铁法,硫容偏低。由于煤气经水解装置后温度较低,氧化锌脱硫剂在该条件下硫容偏低,且氧化锌价格昂贵,脱硫后产物无法再生,因此不适用于高炉煤气精脱硫。
1.8.3 活性炭脱硫剂
活性炭作为常见吸附材料,对H2S具有良好的脱除效果。其适用温度为5~60℃,包括吸附、催化反应两方面作用[18]。由于高炉煤气中H2S分压占比很低,活性炭对H2S的吸附硫容较小,其表面活性基团对H2S的催化作用占主要部分。煤气中微量氧作用下,H2S在活性炭微孔表面被催化成硫单质,反应式如(5)。催化反应所需的氧含量为化学计量比的1.5~2倍,高炉煤气中氧含量可满足该要求![]()
![]()
![]()
![]() 。
。
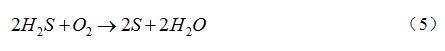
吸附饱和后的活性炭通常再生后重复使用,但再生过程需要高温,且设备繁多、系统庞大,能耗较高进而造成运行费用偏高,同时易造成二次污染,限制了活性炭工艺的规模化使用。
2 高炉煤气精脱硫工艺选择
通过对高炉煤气总硫组分及相关脱除方法的讨论分析,考虑到高炉煤气经过除尘、TRT发电后,系统温度、压力分别在20~100℃、10~15kPa,满足水解催化工艺使用条件,因此将水解催化置于TRT之后。同时,为了保护水解催化剂免受氯等酸性组分的影响,选择在水解催化装置前设置预处理塔,采用固定床结构,填充干式脱氯剂,预先除去煤气中无机氯;针对水解后无机硫的吸收,由于湿法脱硫存在废液难处理等多种弊端,本文优先选择干法脱硫,填充硫容高、成本较低的氧化铁脱硫剂。结合本文上述分析,笔者建议在TRT之后,采用如图1所示的“预处理+水解催化法+干法脱硫”的高炉煤气精脱硫工艺路线。
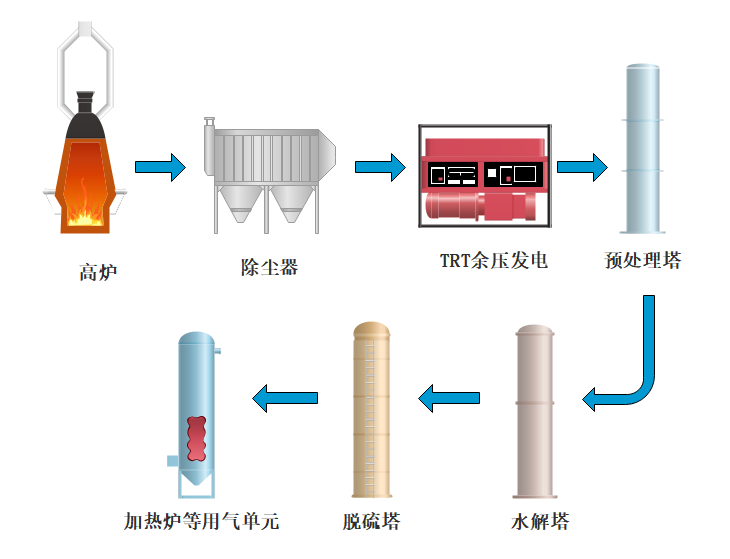
图1 高炉煤气精脱硫工艺路线
本工艺路线中,来自TRT后的高炉煤气,经管网传输至预处理塔,该过程中,若烟温较低且不稳定,应通过升温装置,提升烟温至70~90℃。煤气经升温后由塔底进入预处理塔,塔内填充钙基吸收剂,煤气中的氯及部分硫化氢等污染物得以脱除。之后,高炉煤气进入水解系统,水解塔内置有氧化铝基低温水解催化剂,利用煤气中微量水分将高炉煤气中的COS催化水解为H2S。水解后的高炉煤气经管道输送至脱硫系统,系统内多个脱硫塔并联设置,多塔运行,一塔备用,塔内填充氧化铁脱硫剂,将原煤气中及水解产生的H2S进行吸收处理,最终满足下游用户需要。目前,采用该工艺路线的高炉煤气脱硫装置正在海城市恒盛铸业高炉上建设投产。
3 结语
高炉煤气中有机硫较无机硫含量高,且气量大,下游用户多而分散,采用源头脱硫治理势在必行。通过对现有脱硫技术进行分析,本文提出在TRT之后采用“预处理+水解催化法+干法脱硫”的高炉煤气全干式精脱硫工艺路线。解决了Cl-对后续水解剂的影响和设备管道的腐蚀,同时也可在前端布袋除尘器泄露时对催化剂形成保护屏障。该路线也避免了水解系统对TRT效率的影响,流程简单,运行稳定可靠,且全流程无废液产生,不会造成二次污染,可实现真正意义的精脱硫。
此外,随着钢铁企业节能减排、低碳降耗的推进,高炉煤气精脱硫工艺逐步开始应用,不同工艺各有优缺点,在实际方案选择中,企业还需根据自身情况,比选出适用于自身的精脱硫工艺。
参考文献
[1] 李顺心,吴礼云,刘恩辉,高强.关于高炉煤气精脱硫的探讨[J].山西冶金,2020(2):152-154
[2] 杨正山.钢铁高炉煤气的二氧化碳捕集技术研究[D].2019
[3] 徐志钢,樊响,周景伟,郭明威,谢桂龙.高炉煤气精脱硫可行性工艺路线研究[J].环境工程,2019
[4] 肖俊军,孙同华,毕传光,韩宏松.高炉煤气脱硫技术路径与应用研究[N].世界金属导报.2020-01-07(B12)
[5] LANZERSTORFER C,PREITSCHOPF W,NEUHOLD R, er al. Emissions and removal of gaseous pollutants from the top-gas of a blast furnace[J].ISIJ International,2019,59(3):590-595
[6] 易红宏,赵顺征,唐晓龙.羰基硫低温催化水解技术[M].北京:科技出版社,2014
[7] 韩淑仪,王科,黄勇,祁亚玲,胡玲,焦圣华.醇胺法脱硫脱碳技术研究进展[J].油气加工,2014,32(3):19-24
[8] 王冠.催化水解发低温脱除煤气中羰基硫的研究[D].上海交通大学,2014
[9] 张晓东,易红宏,唐晓龙,赵顺征,韩文,马传博.羰基硫、CS2水解催化剂及脱硫机理研究现状与进展[J].化工新型材料,2020,48(5):266-270
[10] 梁键星,李咸伟,刘道清,顾嘉南,孙同华,贾金平.协同催化水解羰基硫和二氧化碳的低温催化剂研究进展[J].材料导报
[11] 邹晓超.解析高炉煤气精脱硫可行性工艺路线[J].现代工业经济和信息化,2020(4):76-79
[12] 李翔,王学谦,李鹏飞,王郎朗,宁平,马懿星,曹睿,钟磊.高炉煤气特征组份分析及其对脱硫过程的影响[J].化工进展,2021
[13] 王国兴,黄新伟,叶敬东,王俊士,孔渝华.T504型常温COS水解催化剂的研制[J].湖北化工,1995(1):24-28
[14] 胡典明,孔渝华,魏华,叶敬东,王先厚,肖安陆,祝汉生.EH-4丙烯专用COS水解催化剂的性能评价[J].化学与生物工工程,2004(3):44-45
[15] 胡宾生,贵永亮,胡桂渊,吕凯,宋春燕.高炉炉顶煤气中HCl气体脱除的试验研究[J].环境工程,2016:(78-80)
[16] 张翠清.常温铁系煤气脱硫剂的研究[D].煤炭科学研究总院,2014
[17] WANG T,HU B,LI J, et al. Removal of Hydrogen Sulfide by Hydroxyl Ferric Oxide in a Slurry Reactor at Low Temperature[J].Industrial&Engineering Chemistry Research,2020,59(4):1402-1412
[18] Sakanishi K, Wu Z H , Akimitsu M, et al .Simultaneous removal of H2S and COS using activated carbons and their supported catalysts[J].Catalysis Today,2005,104:94-100
