全荣
如果在焦炭表面涂覆催化剂,可以促进气化反应;相反,如果涂覆高熔点的惰性物质,就可隔断 CO2 与焦炭的接触,抑制气化反应。本文采用更换使用的物质,作为控制气化速度的方法,研究了在焦炭表面涂覆不同物质对竖炉焦比的影响。本文中,作为反应促进剂,使用了 CaCO3 和 Fe2O3,作为反应抑制剂,使用了 SiO2,在 1773K 以下的温度范围,测量气化速度,并公式化。将获得的速度公式用于数学模型,评价了对竖炉操作的影响。
钢铁生产工艺中最上游的炼铁工序,在消耗大量能源的同时,排放出大量的高热值煤气,成为下游工序重要的能量供给源。竖炉(化铁炉)用焦炭的燃烧热熔化废钢、生产铁水的同时,排放出富含 CO 气体的高热值煤气,起着能量供给源的重要作用。根据生产量和操作状况,钢铁厂内的能量平衡发生变化,所以要求竖炉根据能量平衡的变化柔性应对。即,厂内的能量不足时,提高焦比,排放出高热值煤气,能量过剩时,降低焦比,降低生产成本。
图 1 是竖炉的示意图,首先,由风口送风中的氧与焦炭的燃烧反应产生 CO2。然后,引起焦炭气化反应,产生 CO。竖炉原料使用还原铁(废钢),所以气化反应产生的 CO 不在炉内消耗,而是直接排放到炉外。气化反应是吸热反应,如果增加反应量,焦比就会上升。但同时产生的 CO增加,排气发热量也上升。反之,如果减少反应量,焦比和排气发热量均降低。因此,如果能够控制焦炭气化反应,就可以控制竖炉的焦比和排气发热量。
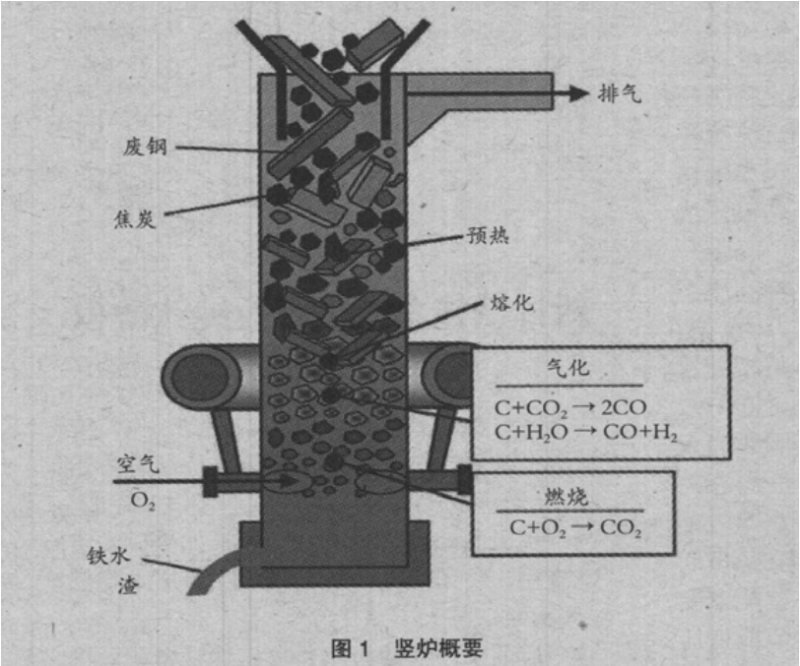
为了促进焦炭的气化反应,有效的方法就是添加催化剂。以前许多报告介绍了添加 Ca 和 Fe,促进反应的方法。但是,这些多数是为了降低高炉热平衡带温度,在 1273K 接近气化开始温度附近进行的研究。而竖炉的气化反应在 1773K 以上的温度区域活跃。对该温度区域的了解不够。而且,对控制气化反应的方法,几乎没有常规的知识。
1 焦炭气化试验
1.1 试验方法
1.1.1 各化合物对活化能影响的评价
评价了焦炭和各化合物(CaCO3、Fe2O3、SiO2)单独接触对气化反应活化能的影响。将各试样 粉碎为 150μm 以下、混合,进行了热重量测量(TG)。表 1 是使用焦炭的特性。试验使用的是将 焦炭 10mg 与各化合物 5mg 进行混合的试样。气化反应中有化学反应、晶内扩散、气膜传质三种 反应,低温近似化学反应速率,高温近似气膜传质速率。
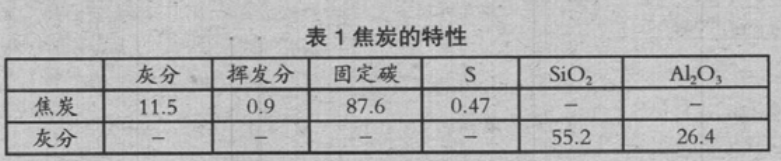
在该测量中,为了评价活化能的变化,按化学反应速率设定试验条件。首先,预升温,在 N2 气 1NL/min 的条件下,以 40K/min 升温到 1073K。然后,切换为 CO2/N2(30/70)系 1NL/min 的 条件,一边以 1K/min、2K/min、5K/min 等速度升温,一边测量了重量变化。
1.1.2 焦炭表面涂覆化合物时反应速度的测量
评价了焦炭表面涂覆 CaCO3、SiO2、Fe2O3,对气化速度的影响。试样使用破碎分级为 10-11mm 的焦炭。使分级为 150μm 以下的各化合物悬浮于水中,制备成浓度 33wt%的悬浮液,将焦炭浸渍在悬浮液中搅拌后,使其自然干燥一昼夜、涂覆。图 2 是气化速度测量装置,内径 80mm 的 SSA-S 炉芯管内,用耐火砖和直径 10mm 的氧化铝球铺底,其上面填充试样。在试样填充层中央设置了热电偶。从炉下部吹入 Ar 气,升温到规定的温度,保持 30min 后,切换为 CO2/N2(=15/85)系气体,使其在恒定温度反应。在装置的限制内再现竖炉内的气化条件,温度设定为 1573K、1673K 和1773K,气体空塔速度为 0.27Nm/s。从反应中的重量变化求出气化速度。
1.2 试验结果及分析
1.2.1 各化合物对活化能的影响
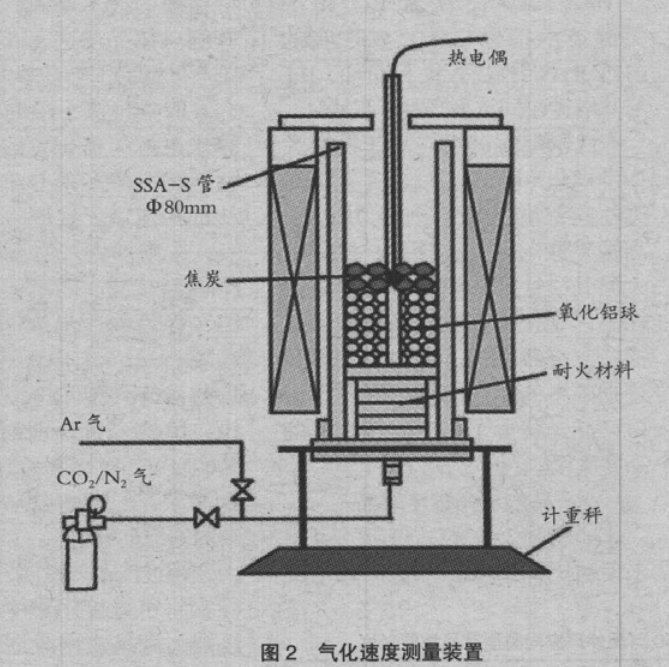
图 3 是在各条件下测量的反应率与温度的关系。反应率由相对初始 C 重量的重量减少比率求出,但混合 CaCO3 时的分解反应的重量减少部分除外。从图 3 可以看出,混合 SiO2 与单纯焦炭时的反应速度几乎没有变化。但混合 CaCO3、Fe2O3 时,反应速度上升。基于该结果,采用Friedman-Ozawa 法求出活化能。在该方法中,对反应速度(1)式两侧取自然对数得到(2)式,在各升温速度下,将 ln(dα/dt)与 1/T 的关系绘制的直线的斜率,对应活化能 Ea。
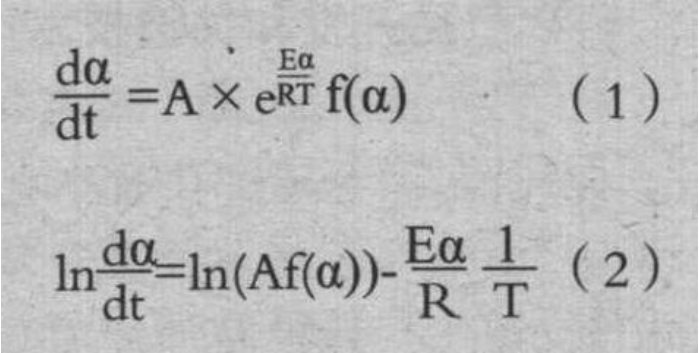
式中:α-反应率;A-频率因数,1/s;Ea-活化能,J/mol;R-气体常数,J/(K·mol);T-温度, K。
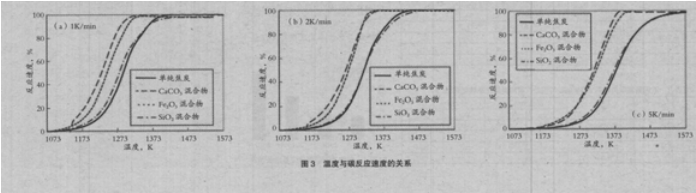
图 4 是混合各化合物时的 ln(dα/dt)与 1/T 的关系。单纯焦炭时与混合 SiO2 时,获得的活化能分别是 2.33×105 kJ/kmol,2.36×105 kJ/kmol,没有大的变化。但混合 CaCO3 时,活化能降低到2.19×105 kJ/kmol。认为这是 Ca 的催化剂效应所致。而与 Fe2O3 混合时,活化能上升到 2.94× 105 kJ/kmol。常规上,Fe 基催化剂,Fe 的状态是最活跃的,在氧化物的状态活性下降。有报告介绍,采用各种气体组成,变化 Fe 的氧化状态,测量气化速度时,在 Fe3O4 的状态促进气化速度。
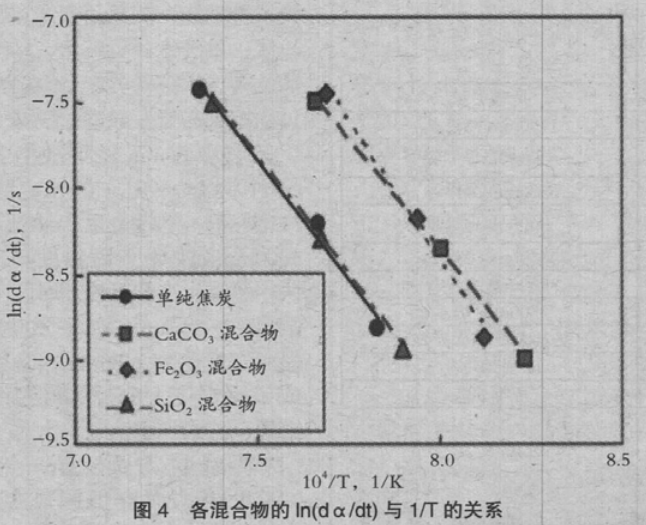
在本试验中,焦炭与Fe2O3混合时,在预升温到1073K的过程,与单纯焦炭相比,重量减少约0.2mg。
由于 Fe2O3 与 C 直接还原,完全还原为 Fe3O4 时的重量减少量约 0.3mg,所以推测试验开始时大 部分为 Fe3O4。最终的重量变化与单纯焦炭时几乎没有变化,在本试验中 Fe3O4 为稳定的化学组成,根据氧化还原反应式(3)、(4)推测,促进了气化反应。
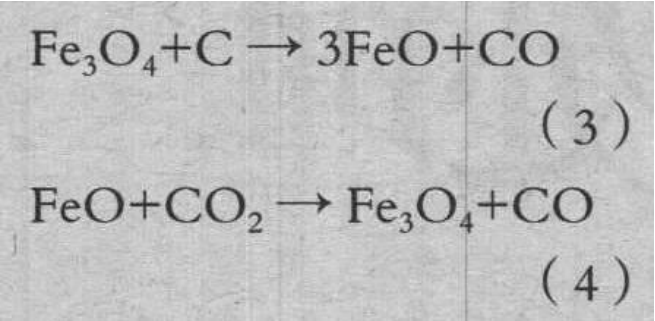
推测其中(3)式的反应支配全反应速度,该反应温度越高越加速,所以气化反应也是温度越高越促进反应,表观活化能上升。
1.2.2 焦炭表面涂覆各化合物时的反应速度
从涂覆前后试样的重量差,求出焦炭表面涂覆 CaCO3、Fe2O3、SiO2 的量分别是 9wt%、4wt% 和 3wt%。推测各化合物主要存在于焦炭表面和其附近的粗大气孔内。研究了不同温度各涂覆焦炭反应速率随时间的变化。在此,从测量结果求出的反应速度 dα/dt 如(5)式所示,作为与 CO2浓度和 C 的未反应率(1-α)的积成正比,求出反应速度常数 k。
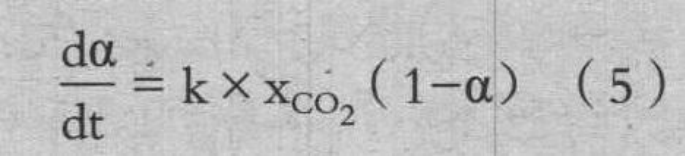
式中:α-反应率;t-时间,s;k-总反应速度常数,1/s;
XCO2-CO2 摩尔分数。
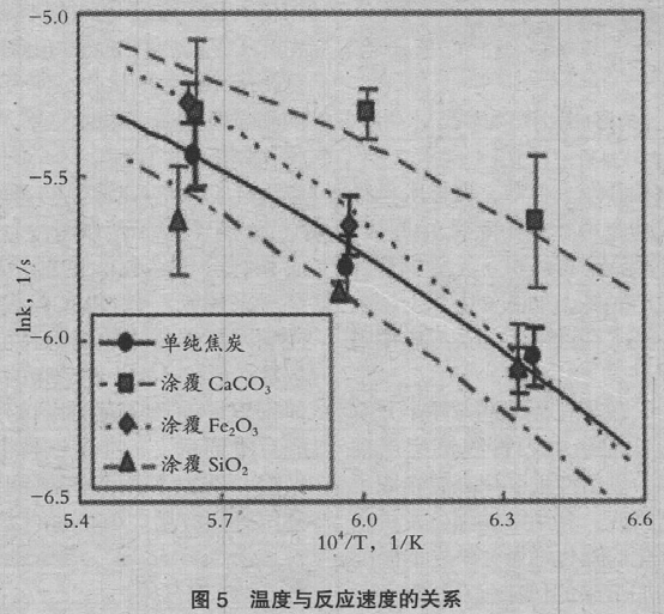
5 是由各测量结果求出的 k。图中的图形是试验结果,各线是计算结果。涂覆 CaCO3 时, 与上述的 TG 结果一样,气化速度上升。涂覆 Fe2O3 时,气化速度在 1673K 以上上升,在 1573K 与不涂覆化合物时是同样程度。认为这是由于涂覆使与 CO2气体的接触隔断效果与促进反应效果 相抵消。此外,涂覆 SiO2 时,气化速度降低。认为这是由于涂覆隔断了与 CO2 气体接触的效果。
本试验条件接近气膜传质速率,所以采用(6)式的总反应速度式,分析了反应速度。
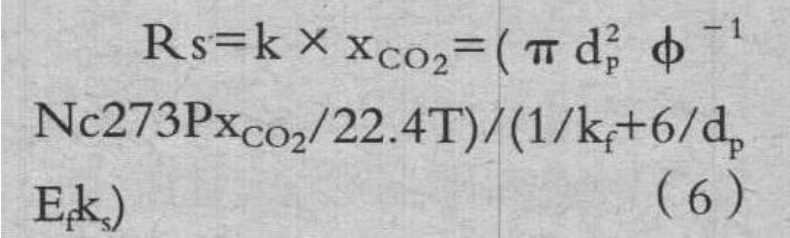
XCO2-CO2 摩尔分数。T-温度,K;kf:膜传质系数,m/s;Ef:反应有效系数;ks:焦炭的化学反应速度常数,1/s。
为了简单化,采用了阿累尼乌斯方程公式。活化能 Ea 使用上述 TG 获得的值,将频率因数 A 为拟合参数,(6)式的计算结果拟合为适合本试验结果,拟合后的 ks 示于(7)式。
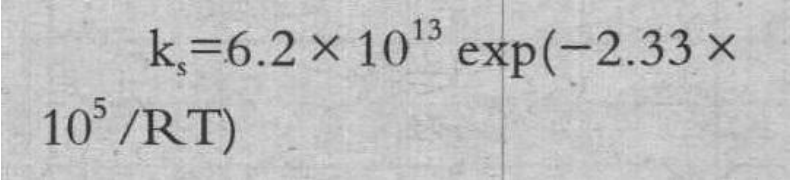
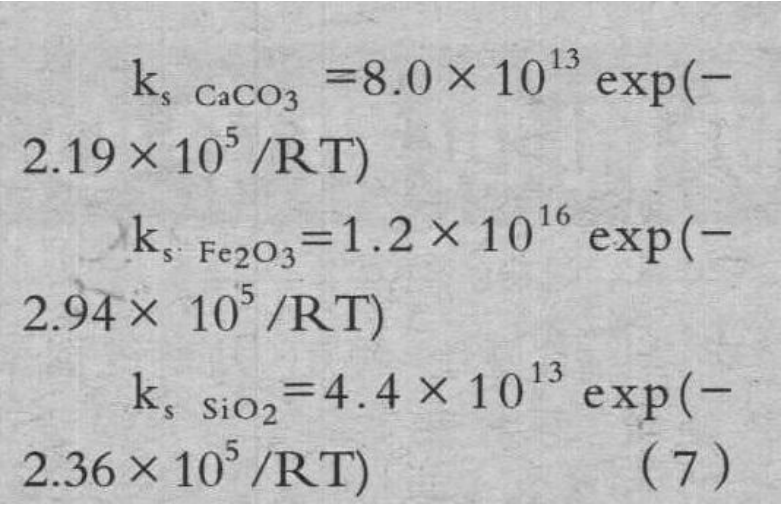
式中:ks:焦炭的化学反应速度常数,1/s;ksCaCO3,ksFe2O3,KsSiO2:涂覆 CaCO3、Fe2O3、SiO2 焦炭的化学反应速度常数,1/s。
将(7)式代入(6)式,计算总反应速度常数 k 的结果,在图 5 中用各线示出。计算结果良好地呈现了试验值。
2 竖炉操作模拟
2.1 计算方法
为了评价焦炭气化控制对竖炉操作的影响,用一维数学模型进行了模拟。首先,作为案例研究,将气化速度 Rs’,设为 Rs’=γRS,变化参数γ,进行了相对气化速度的焦比、煤气利用率ηCO的敏感性分析。然后,采用试验获得的表面涂覆时的气化速度公式,计算了促进和抑制气化时的焦比、排气发热量。作为涂覆剂,促进气化时使用 CaCO3,抑制气化时使用 SiO2。这些可以和作为竖炉副原料使用的石灰石和石英置换,还可兼顾渣碱度调整功能。
2.2 计算结果
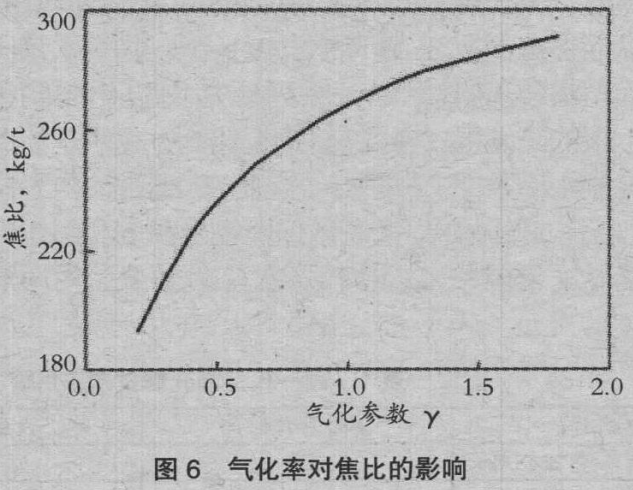
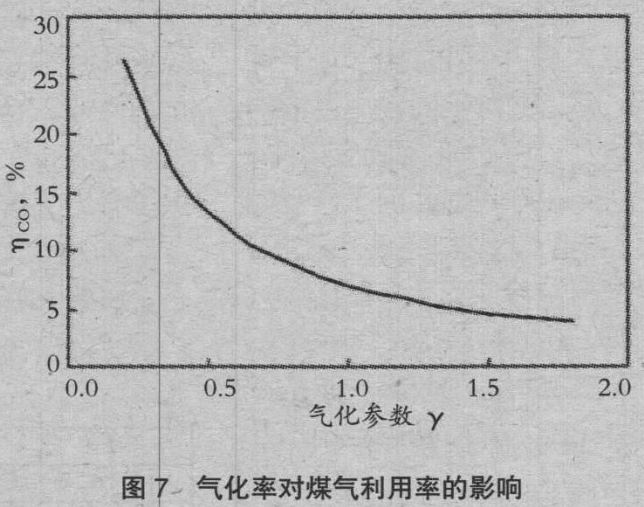
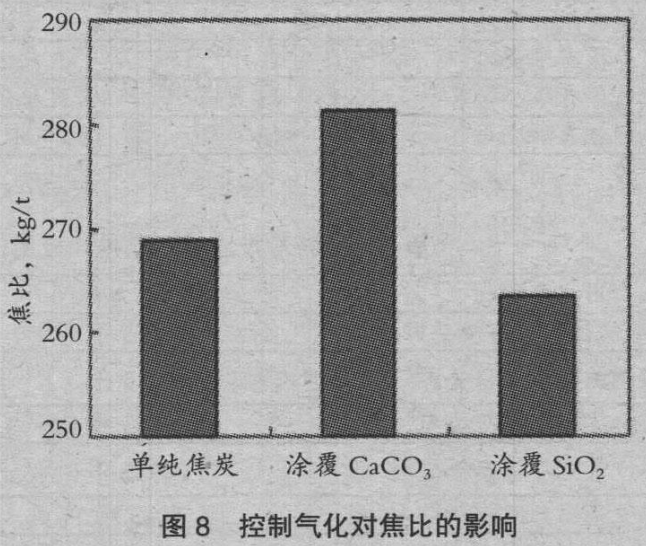
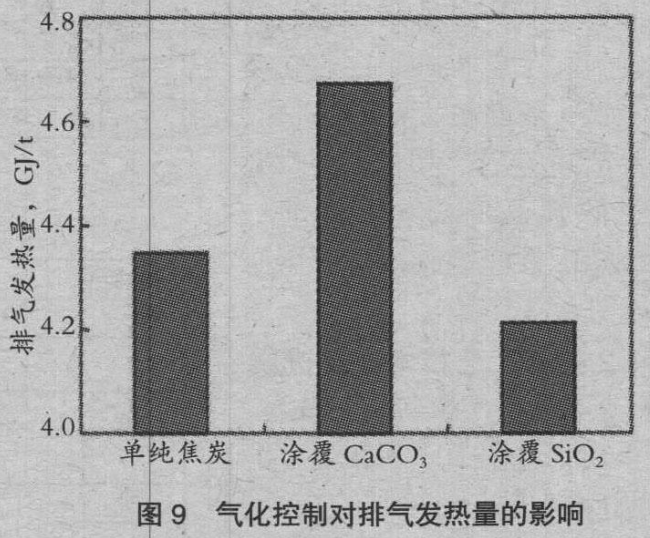
图 6、图 7 是变化气化速度参数时的焦比、煤气利用率ηCO。的变化。气化速度越大,焦比上升,ηCO 降低。随着ηCO 接近零,焦比的上升也变得缓慢。γ=1 是通常焦比的情况,清楚了通过控制气化速度,可以控制焦比和ηCO。图 8 是涂覆使焦比的变化,图 9 是涂覆使排气发热量的变化。由于涂覆 SiO2,焦比降低 5kg/t,涂覆 CaCO3,排气发热量上升 0.33GJ/t。据此说明控制气化的有效性。
3 结语
为了柔性应对钢铁厂内能量平衡的变化,通过控制焦炭气化速度,控制竖炉的焦比和排气发热量,研究了焦炭表面涂覆化合物的气化控制方法,得出以下结论。
1)气化反应的活化能,即使在焦炭中混合 SiO2 也基本不变化。但混合 CaCO3 时,气化反应的活化能降低,混合 Fe2O3时上升。
2)焦炭表面涂覆 SiO2 时,气化速度降低,涂覆 CaCO3 时,气化速度上升。涂覆 Fe2O3 时,温度越高气化速度越快。
3)采用模拟竖炉操作,计算了焦炭表面涂覆 SiO2 时,焦比降低 5kg/t,涂覆 CaCO3 时,排气发热量上升 0.33GJ/t,说明了气化控制的有效性。


